細(xì)胞活力的測(cè)定在生命科學(xué)和生物技術(shù)的許多領(lǐng)域都是必不可少的環(huán)節(jié)���。傳統(tǒng)上�����,細(xì)胞活力通常通過(guò)寬視野光學(xué)顯微照片中染色細(xì)胞的半自動(dòng)或自動(dòng)計(jì)數(shù)來(lái)確定,通常這種檢測(cè)方法需要額外的染色標(biāo)記過(guò)程�,故很難作為在線或原位快速檢測(cè)的手段。Ampha Z32微流控阻抗流式細(xì)胞儀(IFC)是一種基于Coulter原理的無(wú)需標(biāo)記的單細(xì)胞檢測(cè)技術(shù)��,可在線快速�、準(zhǔn)確測(cè)定懸浮液中單細(xì)胞的活性狀態(tài)����。Ampha Z32不含光學(xué)元件�,無(wú)需調(diào)整和校準(zhǔn),便于攜帶�,不僅可在實(shí)驗(yàn)室使用,還同樣適用于實(shí)驗(yàn)室外的檢測(cè)�。此前,Ampha Z32多用于花粉質(zhì)量分析�,但目前其也逐步應(yīng)用到細(xì)胞生物學(xué)的許多領(lǐng)域,如檢測(cè)癌細(xì)胞的活力��、分化和凋亡(Ampha Z32阻抗流式細(xì)胞儀在癌細(xì)胞狀態(tài)鑒定中的應(yīng)用)����;監(jiān)測(cè)牛紅細(xì)胞寄生蟲(chóng)感染過(guò)程;成纖維細(xì)胞分化為脂肪細(xì)胞的研究��;甚至是納米材料毒性評(píng)估(Ampha Z32阻抗流式細(xì)胞儀在納米材料毒性篩選中的應(yīng)用)等方面��。本文利用Ampha Z32精確并快速的評(píng)估了正常和熱滅活���、發(fā)酵過(guò)程中以及長(zhǎng)期好氧間歇培養(yǎng)過(guò)程中酵母細(xì)胞的細(xì)胞活力和細(xì)胞狀態(tài),并與常規(guī)染色方法進(jìn)行了比較����。此外�����,還監(jiān)測(cè)了感染桿狀病毒后昆蟲(chóng)細(xì)胞活性的變化并預(yù)測(cè)了胞內(nèi)蛋白的理想收獲時(shí)間��。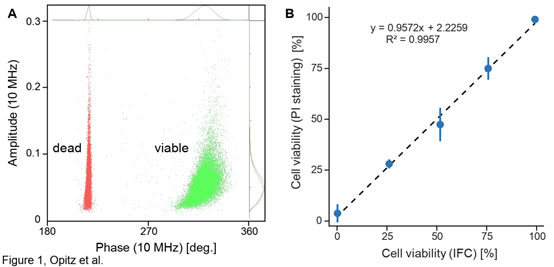
圖1 IFC法與PI熒光染色法測(cè)定的酵母活性的相關(guān)性A)10MHz頻率下釀酒酵母(Scc ATCC 9080)活細(xì)胞(未處理�;綠點(diǎn))和死細(xì)胞(熱處理��;紅點(diǎn))的IFC相位角(x軸)-振幅(y軸)疊加散點(diǎn)圖���;B)IFC法(n=3�,std=0.15%)和染色法(n=3��,std=4.4%)的相關(guān)性分析(R2=0.996)IFC法:本實(shí)驗(yàn)中未經(jīng)處理和熱處理的酵母死細(xì)胞樣品按預(yù)定比例(1:0�����、3:1��、1:1�����、1:3、0:1)混合至100μl����,之后用AF6緩沖液進(jìn)一步稀釋至2ml,經(jīng)20μm過(guò)濾器過(guò)濾后上機(jī)測(cè)試�,三次重復(fù),細(xì)胞采集數(shù)目設(shè)定為20000����。PI法:200μl AF6和100μl 3.0μg/ml碘化丙啶(PI)稀釋100μl上述未經(jīng)處理/熱處理的細(xì)胞混合物,并使用熒光顯微鏡(Leica)計(jì)數(shù)PI染色(死亡)和未染色(存活)細(xì)胞����。實(shí)驗(yàn)結(jié)果表明,相較于傳統(tǒng)染色鏡檢法�,Ampha Z32阻抗流式細(xì)胞儀(IFC)操作簡(jiǎn)單、測(cè)量快速����,是一種統(tǒng)計(jì)性、重復(fù)性�、測(cè)量精度以及標(biāo)準(zhǔn)化程度都更高的檢測(cè)方法。常規(guī)培養(yǎng)下和兩性霉素B(Sigma)處理后釀酒酵母活性的變化
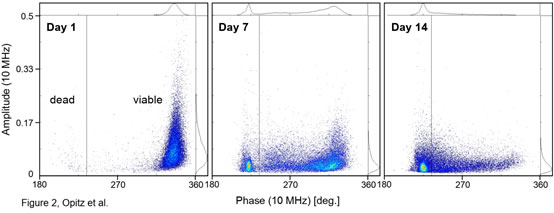
圖2 常規(guī)培養(yǎng)下釀酒酵母(Scc ATCC9080)活性的變化(IFC法)
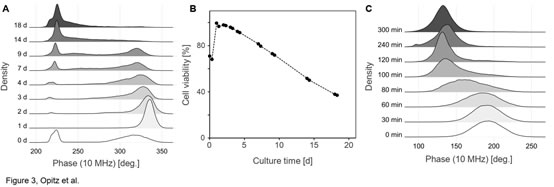
圖3. 常規(guī)培養(yǎng)下和兩性霉素B(Sigma)處理后釀酒酵母活性的變化A)常規(guī)培養(yǎng)下����,釀酒酵母(Scc ATCC 9080)活性相位直方圖隨時(shí)間的變化(10 MHz)。B)酵母活性隨培養(yǎng)時(shí)間的變化曲線��。C)在添加1μg/ml的兩性霉素B后的0-5h內(nèi)���,釀酒酵母(Scc ATCC 9080)活性相位直方圖的變化釀酒酵母(Scc ATCC 9080)常規(guī)培養(yǎng)��,即250 ml錐形瓶中在28°C的搖動(dòng)培養(yǎng)箱中培養(yǎng)數(shù)天��,培養(yǎng)基為100 ml YPD�。兩性霉素B(Sigma)處理��,即將常規(guī)培養(yǎng)中處于指數(shù)生長(zhǎng)時(shí)期的釀酒酵母細(xì)胞暴露于1μg/ml的兩性霉素B中��。圖2為接種培養(yǎng)后的第1�����、7和14天�����,釀酒酵母的相位-振幅散點(diǎn)圖的變化����,從圖中可以看出�����,在接種培養(yǎng)的第7天出現(xiàn)兩個(gè)明顯可區(qū)分的類群�����。在培養(yǎng)的18天中����,可以清晰看到活性酵母類群的逐漸向低相位和較小振幅移動(dòng)(圖3A)�,也就是說(shuō),隨著培養(yǎng)時(shí)間的延長(zhǎng)�,酵母細(xì)胞活性逐漸下降(圖3B)。此過(guò)程反映了在長(zhǎng)期好氧間歇培養(yǎng)中���,因營(yíng)養(yǎng)限制而導(dǎo)致的酵母細(xì)胞的死亡過(guò)程�。圖3C同樣觀察到經(jīng)兩性霉素B(Sigma)處理后�,釀酒酵母細(xì)胞的活性逐漸降低,但這一過(guò)程反映的是毒性化合物誘導(dǎo)下酵母細(xì)胞的死亡過(guò)程���。這表明IFC還可應(yīng)用于懸浮細(xì)胞的無(wú)標(biāo)記毒理學(xué)研究���,例如用于IC50值的測(cè)定�����。
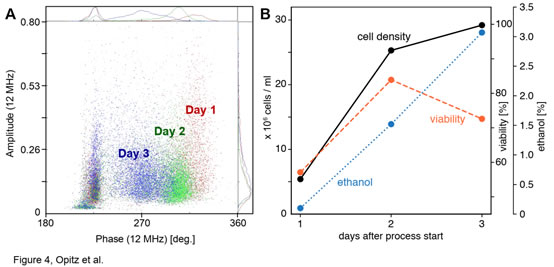
圖4. 釀啤酒造過(guò)程中釀酒酵母活性的變化A) 開(kāi)始發(fā)酵后的前3天,酵母細(xì)胞的相位-振幅散點(diǎn)圖變化��。B) 發(fā)酵過(guò)程中的酵母細(xì)胞的密度(黑色)����、活力(橙色)和乙醇濃度(藍(lán)色)隨時(shí)間的變化。啤酒釀造發(fā)酵罐中的生長(zhǎng)條件與前面討論的情況不同�,圖4記錄了酵母的發(fā)酵過(guò)程,開(kāi)始的第1天(紅色)到第2天(綠色)�,酵母細(xì)胞呈指數(shù)增殖,細(xì)胞濃度從5.4增加到25.3 x 106細(xì)胞/ml��,細(xì)胞活力從57.1增加到83.9%(圖4B)����。第3天結(jié)束時(shí),酵母細(xì)胞(藍(lán)色)移向較低的相角�����,這意味著細(xì)胞濃度的增長(zhǎng)減慢,細(xì)胞活力下降�����。而發(fā)酵罐中乙醇濃度從第一天的0.1%迅速增加到第三天的3.1%(圖4B)�����。這是由于培養(yǎng)第一天細(xì)胞濃度低����、活力低且發(fā)酵罐中仍存在大量氧氣,當(dāng)發(fā)酵罐中的氧氣全部消耗完后��,酵母轉(zhuǎn)入?yún)捬跻掖及l(fā)酵����,乙醇濃度迅速增加,而乙醇濃度增加又會(huì)對(duì)酵母細(xì)胞產(chǎn)生毒性���,故酵母細(xì)胞活性降低���。IFC的檢測(cè)到的活性相位變化與以上響應(yīng)過(guò)程高度一致。Sf9昆蟲(chóng)細(xì)胞活性檢測(cè)本文利用Ampha Z32(IFC)分別跟蹤了感染和未感染染桿狀病毒(BV)的Sf9昆蟲(chóng)細(xì)胞培養(yǎng)物在首次傳代后的99h內(nèi)的活力變化���。
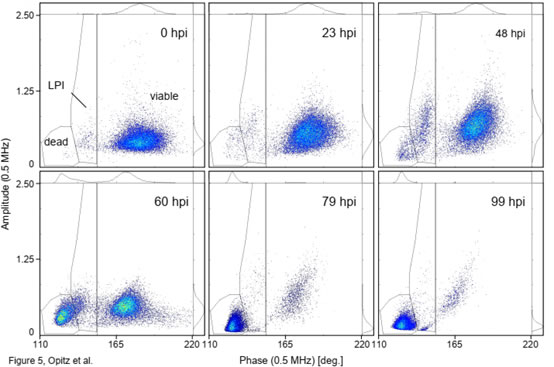
圖5 感染桿狀病毒(BV)后的Sf9昆蟲(chóng)細(xì)胞活性的變化
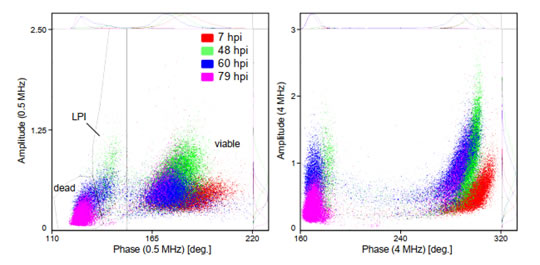
圖S4 感染桿狀病毒(BV)后的Sf9昆蟲(chóng)細(xì)胞活性相位疊加圖上圖為Sf9昆蟲(chóng)細(xì)胞在感染桿狀病毒后的數(shù)小時(shí)(hpi)內(nèi)�����,相位-振幅散點(diǎn)圖的變化(0hpi為感染前的參考培養(yǎng)物)�����。在BV感染從0到99 hpi的整個(gè)過(guò)程中�,相位-振幅散點(diǎn)圖的可明顯分離出三個(gè)細(xì)胞類群����,分為是活細(xì)胞(viable)、感染晚期(LPI)和死細(xì)胞(dead)類群(圖5)�。類似于酵母(圖1),在較高的相位值(150?到220?)下分離出“活”細(xì)胞類群���。這部分活細(xì)胞在感染后的0-48hpi����,阻抗振幅增加了約60%��,這與感染后細(xì)胞的“膨脹”狀態(tài)相一致�����。阻抗振幅的變化提供了感染水平的定量讀數(shù),可用于從病毒滴定分析中確定病毒與細(xì)胞比率(感染多重性���,MOI)����。48hpi后���,活細(xì)胞的阻抗振幅降低(細(xì)胞萎縮)且數(shù)量逐漸減少�����,直至99hpi細(xì)胞全部死亡(見(jiàn)圖6)��。感染晚期(LPI)細(xì)胞類群出現(xiàn)在較低相位�����,這部分細(xì)胞在0-60hpi逐漸增加隨后減少直至消失���,這是由于感染后期的細(xì)胞裂解所致。
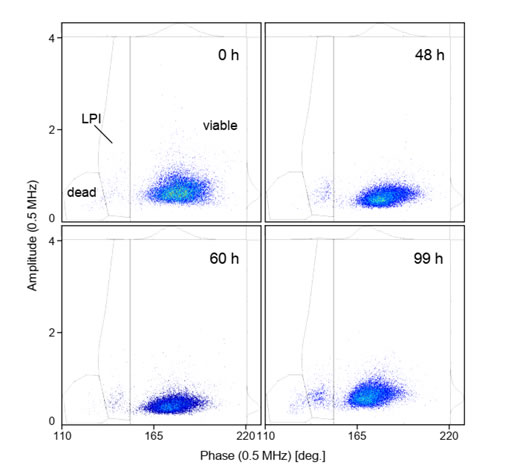
圖S3 未感染桿狀病毒(BV)的Sf9昆蟲(chóng)細(xì)胞活性的變化上圖為未感染桿狀病毒(BV)的Sf9昆蟲(chóng)細(xì)胞活性的變化�����,同感染細(xì)胞一致,相位-振幅散點(diǎn)圖也可分離出活細(xì)胞(viable)�、感染晚期(LPI)和死細(xì)胞(dead)類群。如圖所示���,細(xì)胞活力(97.9 %±0.7 %)在79 hpi的連續(xù)生長(zhǎng)過(guò)程中始終保持不變���。僅當(dāng)在99 hpi超過(guò)典型的繼代間隔時(shí)間時(shí),細(xì)胞活力下降至約93.1%��,這可能是由于營(yíng)養(yǎng)限制或細(xì)胞密度過(guò)高所致�。與感染的Sf9昆蟲(chóng)細(xì)胞的相位-振幅散點(diǎn)圖(圖5)相比�����,未感染細(xì)胞的振幅分布(與細(xì)胞大小相關(guān))在0-60h內(nèi)略有變窄�����,而直到60h才明顯檢測(cè)到LPI(感染晚期)細(xì)胞類群�,到99h時(shí)該類群略有增加。感染桿狀病毒(BV)后的Sf9昆蟲(chóng)細(xì)胞活力和重組蛋白表達(dá)的時(shí)間動(dòng)力學(xué)變化本文除利用IFC法���、臺(tái)盼藍(lán)染色鏡檢法追蹤了感染桿狀病毒(BV)后的Sf9昆蟲(chóng)細(xì)胞活性的動(dòng)力學(xué)變化��,還同時(shí)利用綠色熒光蛋轉(zhuǎn)染Sf9細(xì)胞以量化重組蛋白的產(chǎn)量��,下圖為感染桿狀病毒(BV)后的Sf9昆蟲(chóng)細(xì)胞活力和重組蛋白表達(dá)的時(shí)間動(dòng)力學(xué)變化����。
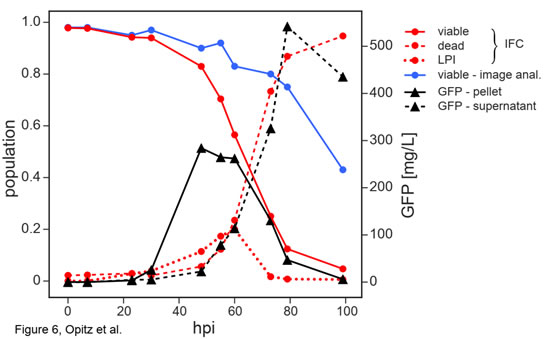
圖6 感染桿狀病毒(BV)后的Sf9昆蟲(chóng)細(xì)胞活力和重組蛋白表達(dá)的時(shí)間動(dòng)力學(xué)變化結(jié)果表明,在感染BV后的24hpi內(nèi)��,IFC法與臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)器的檢測(cè)結(jié)果高度一致�;24-60hpi內(nèi),IFC法檢測(cè)到的活性快速下降到50%(紅實(shí)線)��,而臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)器檢測(cè)到的細(xì)胞活性下降緩慢�����,僅從100%下降到80%(藍(lán)實(shí)線)�����;從60hpi后����,細(xì)胞活性均快速下降�����,但到99hpi時(shí)�,IFC法的檢測(cè)結(jié)果僅為5%���,而臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)器的檢測(cè)結(jié)果為42%�����;整個(gè)測(cè)試過(guò)程中����,兩者差異在79hpi時(shí)達(dá)到最大���,分別為11%和78%。79hpi的相位-振幅散點(diǎn)圖(圖5)表明此時(shí)IFC法可以準(zhǔn)確捕捉到細(xì)胞阻抗信號(hào)發(fā)生了巨大變化(細(xì)胞的大規(guī)模重組)���,而臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)器卻不能及時(shí)檢測(cè)到這一變化�����。感染桿狀病毒(BV)后的Sf9昆蟲(chóng)細(xì)胞大小的變化在BV感染的不同階段����,細(xì)胞大小有顯著差異。因此��,臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)法通常用細(xì)胞大小表征BV感染的狀態(tài)和重組蛋白的產(chǎn)量質(zhì)量�����。如圖7所示���,在23-60 hpi之間����,感染細(xì)胞從最初的12.8μm膨脹到約16μm���,然后在99 hpi時(shí)最終縮減到8.5μm(圖7A��,紅色虛線)��。這與IFC法獲得的平均振幅(圖7A�,黑色虛線)的變化趨勢(shì)非常相似����,分析表明�����,振幅數(shù)據(jù)與平均細(xì)胞大小有很好的相關(guān)性(R2=0.901)(圖7B)����。也就是說(shuō)IFC法不僅可以評(píng)估細(xì)胞的活力��,還可以評(píng)估細(xì)胞的大小��。
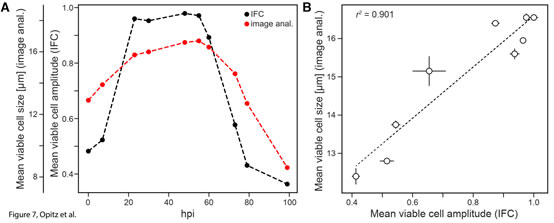
圖7 感染桿狀病毒(BV)后的Sf9昆蟲(chóng)細(xì)胞大小的變化LPI(感染晚期)類群大小與重組蛋白產(chǎn)量的關(guān)系相較于臺(tái)盼藍(lán)成像細(xì)胞計(jì)數(shù)法��,IFC法可進(jìn)一步將失活細(xì)胞區(qū)分為感染晚期(LPI)和死細(xì)胞(dead)兩個(gè)類群(圖5)���。隨感染時(shí)間的延長(zhǎng)�����,LPI類群的細(xì)胞在48-60 hpi內(nèi)逐漸增多,到72 hpi幾乎全部消失����。這一類群的大小與裂解細(xì)胞中檢測(cè)到的表達(dá)trGFPuv的濃度相關(guān)(圖6,紅色虛線和黑色實(shí)線)。隨著B(niǎo)V感染的進(jìn)一步發(fā)展���,表達(dá)的trGFPuv隨細(xì)胞裂解釋放到培養(yǎng)基中(圖6��,黑色虛線)�����,其濃度的變化與IFC確定的死亡細(xì)胞總數(shù)的比例完全一致(圖6�,紅色虛線)��。盡管細(xì)胞外表達(dá)的trGFPuv的數(shù)量最終會(huì)超過(guò)細(xì)胞內(nèi)的trGFPuv�,但培養(yǎng)基中的不必要反應(yīng)和裂解細(xì)胞釋放的蛋白酶可能會(huì)降低表達(dá)蛋白的質(zhì)量,因此研究者并不希望將這部分釋放的蛋白質(zhì)用于后續(xù)應(yīng)用�����。由于IFC法檢測(cè)到的LPI群體與表達(dá)的胞內(nèi)蛋白密切相關(guān)����,因此利用Ampha Z32(IFC)可以很好地預(yù)測(cè)胞內(nèi)蛋白的理想收獲時(shí)間。以上研究表明�����,Ampha Z32(IFC)微流控阻抗流式細(xì)胞儀是一種快速、可靠���、無(wú)標(biāo)記的細(xì)胞活力檢測(cè)技術(shù)����。不僅可以在發(fā)酵過(guò)程中可靠測(cè)定細(xì)胞活力��,細(xì)胞大小的變化�,評(píng)估培養(yǎng)條件;還可以在昆蟲(chóng)細(xì)胞bv感染過(guò)程中篩選理想的表達(dá)條件�、病毒滴度,預(yù)測(cè)BV昆蟲(chóng)細(xì)胞系統(tǒng)中獲得胞內(nèi)蛋白的理想時(shí)間�����,可廣泛應(yīng)用于微生物和動(dòng)物單細(xì)胞的培養(yǎng)中��。


















